想必都知道碳材料各種優異的性能,但為什么碳元素能組成世界上最硬的物質金剛石,也能組成非常軟的物質石墨?石墨為什么能導電而金剛石不能?碳纖維為什么強度高?炭化與石墨化你是不是傻傻分不清楚?本篇試圖給大家普及一點碳材料科學基礎,如果你之前沒上過材料學的專業課,這篇文章可能會幫助你從更專業的眼光思考碳材料的各種問題。我盡可能不用專業詞匯,而用最淺顯的語言來解釋這一切,如果是專業人員,這篇文章或許能幫助你重新架構碳材料知識體系。不管怎么樣,漫談碳纖維系列文章將來所談到任何問題都是以此為基礎的。想要隨時復習這篇文章,趕緊點右上角分享或者收藏吧。
? ? 本文會從原子級別、晶體級別、微觀級別三個尺度來了解碳材料。
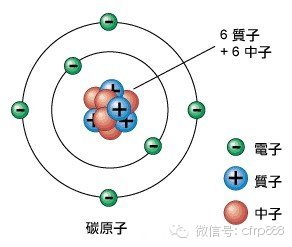
? ? 首先是原子級別。物質是由原子組成的,這個不用多說,原子又是由原子核和核外電子組成,核外電子圍繞原子核旋轉,就像地球圍繞太陽轉一樣。原子核是由質子和中子組成,這個不需要太了解,你只需要知道根據質子的數量不一樣,分成不同的元素。比如質子數為1的是氫、質子數為2的是氦,那么碳元素在元素周期表上排第6位,它的原子核內就有6個質子,而核外電子數量又是和質子數相同的,那么碳原子就有6個核外電子。原子全部重量就集中在原子核內,而電子重量幾乎忽略不計,但可別小看了核外電子,它可是決定著原子如何組成物質的關鍵,不同的物理化學性質都起源于它。
? ? 核外電子在原子核周圍旋轉可是有一定規律的,它是按照距離原子核不同距離的軌道上運動的。就像太陽有八大行星(冥王星已經被開除了),各個行星根據距離太陽遠近分處不同的軌道。但原子核外電子軌道與太陽系行星軌道不同的是,距離原子核最近軌道可以放兩個電子,再遠一點的軌道可以放8個電子,更遠的軌道我們就不說了,因為我們只關心碳元素。這樣就知道了碳原子是由碳原子核和6個核外電子組成,而且碳原子最內層有兩個電子,次外層有4個電子,看圖示1。可是不是說可以放8個電子嗎?放不滿怎么辦?放不滿的話,那就不穩定,不穩定怎么辦?那就想辦法穩定,什么辦法?跟周圍原子分享電子,這樣就穩定了,兩個電子就被綁在一塊了,這就叫共價鍵,想要把兩個電子分開,就需要費很大能量打斷這個共價鍵。一個碳原子跟周圍四個碳原子分別形成一個共價鍵,四個共價鍵相互排斥,在空間上形成最大的角度,每兩個共價鍵夾角109°。于是就形成了我們常看到的金剛石的原子結構如圖示2,大家可以把碳原子看成小球,共價鍵是連接小球的剛性桿,如果要移動任何一個小球,都會牽扯周圍的小球移動,所以除非把連接小球的剛性桿扯斷,否則你是不容易移動小球的,這就是為什么金剛石非常硬了。明白了吧,材料學中任何材料表現的各種性能都有其內在關聯的。另外碳原子核外電子與周圍碳原子形成共價鍵了,電子被固定在兩個碳原子核之間,不能自由移動,即使外加電壓也不行,那么就形不成電流,也就是金剛石不導電。
? ? 這位客官問了,那為什么還有石墨那種六角平面結構呢?回答這個問題之前先端上石墨六角平面結構的圖片吧,說的再好也不如圖片直觀。看圖3.
? ? 不是碳原子有4個核外電子嗎?不是形成8個電子才穩定嗎?不是與周圍4個碳原子形成共價鍵才能解決問題嗎?這圖上碳原子只和3個碳原子形成共價鍵,你以為我不識數啊,這個騙子。客官先稍安勿躁,我忘了給您介紹一個原理了,這就是能量最低原理。山上石頭為什么會往下滾,桌上物體為什么會往下掉?就是因為萬物總會自發的從高能量向低能量轉換,然后將剩余的能量釋放出來,山上石頭河桌上物體能量高,于是自發向下掉,剩余能量就轉化成砸在地面的坑,這個解釋可以理解吧。石墨結構中兩個相鄰碳原子距離近,所以能量低,別問我為什么,你只需要記住石墨這種碳原子在一個平面與其他三個碳原子形成共價鍵,每兩個共價鍵夾角都是120°,這樣的結構能量最低。有人說了,那金剛石結構中碳原子也可以靠近距離啊,哎~這個臣妾做不到啊,因兩個碳原子靠近會受到其他原子的排斥力。是不是很糾結,那石墨結構碳原子為什么能靠近啊,建議各位在紙上畫一畫兩種結構圖,石墨碳原子共價鍵夾角120°,有足夠的空間靠近,金剛石共價鍵夾角109°,沒空間了。空間感差的孩子要撞墻了,別著急,你只需要記住石墨這種結構是最穩定的結構。那又出現一個問題,這么說金剛石能量高,可以自發的向石墨結構轉變了,趕緊把家藏的鉆石賣了吧,萬一哪天拿出來成石墨了,多不劃算啊。這個擔心就多余了,我兜里硬幣怎么不往地上掉?硬幣在我兜里也沒在地上能量低啊,那是因為得有能量使硬幣從兜底跳到兜口才能掉出來,我如果大蹦大跳,給硬幣能量,說不定就掉出來了。同樣,金剛石雖然不穩定,但是它是長期存在的,這叫亞穩態,只有賦予能量才能自發從金剛石轉換成石墨結構,你把金剛石放到高溫下,慢慢就會轉變成石墨了,不信可以試一試,不過別叫我賠。
? ? 再來看石墨這種結構吧,一個碳原子與周圍三個碳原子形成共價鍵,那剩余的一個電子就游離在這個平面的上面或下面,每個碳原子就有一個多余的游離電子,這就是石墨烯結構。碳原子穩定了,對游離電子束縛小了,加上電壓游離電子就會非常迅速的定向移動,這就是為什么石墨烯屬于超導材料,導電率非常好,幾乎沒有電阻,這也是石墨材料為什么會導電的原理。另外碳六角平面上一層電子,能吸收可見光,這就可以解釋為什么石墨是黑色的了,光線照射在石墨上,被吸收了,就是黑色。
? ? 說完原子尺度,再來看晶體尺度。什么是晶體?材料學中,原子按照一定規律周期型排列就是晶體結構。看看金剛石結構,都是一個碳原子與周圍四個碳原子形成正立方體的結構周期性的排列,看看石墨結構,都是碳原子與周圍三個碳原子形成六角網格,然后周期性的重復,這就是石墨晶體。石墨材料呢又都是有這樣的六元網平面一層一層疊起來的,兩層六元網平面之間是靠游離電子相互吸引堆垛起來的。這個結合力是非常弱的,所以在外力作用下非常容易滑落,這就是為什么石墨可以作為潤滑油的添加劑,因為兩個平面可以自由滑動,起到潤滑作用,這也是為什么鉛筆要用到石墨,鉛筆在紙上劃的時候,一部分網平面被摩擦下來,粘附在紙上。
? ? ? ?為什么碳材料可以耐腐蝕呢?你看看煤炭在地底下賣了幾億年,土壤這么復雜的環境下都不受腐蝕。你看看舊時候木頭電線桿子表面都燒黑了埋在地下,就是因為表面木頭燒成木炭,防止木頭電線桿子爛在土壤里。這些都是因為碳材料耐腐蝕。因為碳跟其他元素結合反應活性很高,也就是說常溫下很難反應,所以能耐腐蝕。那為什么碳跟氧氣反應這么劇烈,煤炭容易燃燒,石墨容易氧化。這個要從燃燒的原理來講,碳原子跟氧原子結合,需要將原來碳原子與碳原子的化合建打斷,然后再跟氧原子形成化合鍵。因為打斷碳原子與碳原子之間的化合鍵需要的能量比碳原子與氧原子形成化合鍵能量低。也就是說,碳原子與氧原子一結合,放出的能量會把周圍碳原子與碳原子之間的化合建打斷,這樣碳原子與氧原子就會不斷結合,碳原子與碳原子化合建不斷被打斷,這就是燃燒。
? ? 說到晶體結構,那肯定得有原子排列沒有規律的吧,這就是非晶體,像無定形碳就是非晶體的。其實這都是相對的概念,世界上沒有完美的晶體,即使單晶體里面也會有不按規律排列的原子。無定形碳就是碳原子排列比較雜亂,幾乎沒什么規律,還有的碳原子剩余不飽和的電子,也就是說沒有形成穩定化合建。這樣無定形碳就很容易跟氧氣反應,因為氧原子首先跟沒有形成化合建的碳原子結合,然后下面的燃燒就自發進行了。
? ? 再來看微觀級別吧。上面說到單個晶體原子都是按規律排列的,如果整個物體都是這樣有規律的排列,那就是單晶。但這樣的物體很少見,大多數是由原子組成單晶的小晶粒,小晶粒再結合成物體。晶粒與晶粒之間也不一定有明顯界限,可能是晶粒之間的晶界只是排列稍微雜亂了點,它們之間碳原子也是共價鍵連接。拿石墨組成來看,碳原子組成六元網格,然后六元網格疊加成為石墨小晶粒,石墨晶粒與相鄰的石墨晶粒可能錯層連接,或者網格方向錯位連接就形成石墨物體。如果要施加外力將六元網格扯斷,是非常難的,因為碳原子和碳原子結合共價鍵非常強。但若有排列不規則或某個地方缺少碳原子,那么這些地方結合力就相對較弱,裂紋就會沿著這樣的地方擴展,如果用顯微鏡觀察,石墨被拉斷的端口基本上是沿著晶粒之間的晶界擴展的。
? ? 最后說說碳纖維,如果碳纖維是一個完美碳六角平面單晶的話,那么拉伸強度將達到800GPa,什么概念?T700碳纖維強度是4900MPa,也就是4.9GPa,僅有理論強度的200分之一左右。因為碳纖維內部屬于亂層石墨結構,也就是說有石墨六元網格結構,但是網格平面是比較雜亂的,有缺陷存在,這就嚴重限制了碳纖維強度。還有六元網格的取向并非完全平行于纖維的長度方向,這個也限制了碳纖維的強度。
點擊標題,查看相關閱讀:
文章來源:碳纖維資訊