說起中國當前最熾手可熱的科學家,大家腦海里第一個跳出來的名字十有八九是韓春雨,除卻研究的重大意義,韓春雨研究環境的簡單、經費緊張已成為大家津津樂道的勵志典范。但近日,方舟子公開發文對韓春雨的“諾獎級”論文的“實驗的可重復性”。
(內容解析請點擊→非著名副教授一鳴驚人,沸騰了學界!)
以下為方舟子《河北科技大學韓春雨“諾貝爾獎級”實驗的重復性問題》的部分節選:
這幾天我陸續收到幾家實驗室的研究人員的來信,反映重復不出韓春雨論文中最關鍵的圖4結果(切割基因組,T7E1和測序),呼吁我關注一下這事。
有些人已在網上生物專業論壇公開討論此事,報告他們沒法重復該實驗,詢問有誰重復出來了。目前還未見有人反映重復出了圖4結果。有的能夠重復論文中的圖3結果(FACS和Western?Blot),但那有可能是假陽性。
據聽報告的人說,韓春雨在北大和遺傳所的報告上都強調,他目前的NgAgo是初級版、需要高超的實驗技巧、等他推出2.0版和Smart版。這些說法跟他在論文里的描述是矛盾的。因為他描述的只是個并不復雜的轉染實驗,T7E1和測序也都是現成的技術,并不需要高超的實驗技巧,按照其提供的步驟應該是不難被重復出來的。
……
我當然不怕被人肉,也不怕挨罵,所以在此問幾個問題:
第一,有沒有人重復出了韓春雨論文中的圖4結果?有的話跟我說一下。
第二,據稱韓春雨在遺傳所的報告上說,重復出來和不能重復的比例是1:3,能重復出來的有20家。那么究竟有哪家實驗室重復出來了?(指圖4結果)這事沒必要保密吧。
第三,韓春雨說做這個實驗“需要高超的實驗技巧”,那么究竟在哪個步驟需要什么樣的高超實驗技巧?
為什么一個新實驗的結果別人都反映重復不出來,原因很多,比如可能是重復出來的都不吭聲,重復不出來的實驗技術不行,論文中隱瞞了關鍵的“實驗技巧”(這不道德),或者論文報告的結果干脆就是編的(這更不道德)。一個新的科學發現、技術,需要經過別人的重復才得到公認。別人重復不出來,有疑問,是很正常的。
作為首創者應該做的是去消除疑問,而不是攻擊、謾罵,否則那更讓人懷疑。
重復性=真實性?
方舟子的質疑在網上一石激起千層浪,一些激進的人甚至直接提起了小保方晴子,聲稱:不能重復,真實性就不能保證!
的確,實驗重現性一直是科學家們追求的目標,通常認為只有高重復率的實驗才代表著真是的數據,但把重復性直接等同于真實性,答案還有待考證。Science期刊上的《Estimating?the?reproducibility?of?psychological?science》通訊作者Brian?Nosek關于此提出了他的論點。
他首先提到,研究者需要知道有些因素會導致”文章灌水”,以至于實驗不可重復。一般的”文章灌水”有三種原因,第一是有傾向性地發表支持猜想的數據,第二是只發表有顯著統計學意義的數據,第三是研究樣本數量不夠。這篇發表在《Science》上的研究,還給出了其他原因,即實驗樣品的差異、實驗設定的差異以及實驗完成的質量差異等等。
正如世界上沒有完全相同的兩片樹葉一樣,實驗室樣品也不能說完全一樣,再加之每個實驗室的設備質量、實際使用情況不一,實驗室操作人員熟練程度的參差不齊,人員流動過大等等。比如弗吉尼亞大學研究平滑肌細胞的博士后Laura?Shankman曾表示,如何整合各種方法本身就是一個項目,在短短一段時間里,數個博士后和研究生離開了她所在的實驗室,而留下的人很難確保實驗的一致性。所以客觀上存在很多影響實驗重現性的不可控因素。
然而,對于Brian?Nosek等給出的這三種原因(實驗樣品的差異、實驗設定的差異以及實驗完成的質量差異),也有人并不十分認同前兩者。對于實驗完成的質量的問題,也可能存在這樣的情況,即重復實驗在數據上和原始實驗存在顯著性差異,很可能是重復實驗時候沒有處理好或者操作正確。所以,實驗重現性不能作為檢驗實驗假說的唯一標準,?但同時,我們也不能忽視實驗重現性的作用,我們需要謹慎把握實驗真實性和重現率的平衡。
方舟子的質疑
有人能重復(FACS和Western?Blot),但那有可能是假陽性。
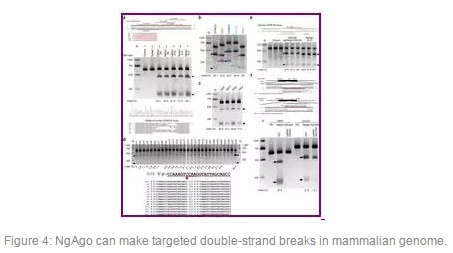
?在圖片3中,研究人員在哺乳動物細胞中比較了NgAgo-gDNA系統和Cas9-sgRNA系統的編輯效率,發現NgAgo-gDNA系統讓靶基因失活的效率與Cas9-sgRNA系統一樣高。利用這種方法,他們還證實對NgAgo而言,單鏈gDNA的最佳長度是24個核苷酸左右。
目前還未見有人反映重復出了圖4結果。
圖片4中,設計了針對人DYRK1A基因的gDNAs,以及另外的八個不同基因的47條guides,效果均不錯,作者還在乳腺癌細胞系MCF-7、人骨髓細胞系K562和HeLa細胞系在內的多種哺乳動物細胞系中測試了NgAgo-gDNA系統,結果發現在所有這些細胞系中,NgAgo都能夠高效地誘導DYRK1A基因靶位點發生雙鏈斷裂,證明了其廣泛的基因組靶向范圍。
同時,作者也設計實驗證明NgAgo介導的靶DNA切割對這個gDNA每個位置上的單核苷酸錯配非常敏感:切割效率下降了73%~100%,其中P8~P11位置上發生的單核苷酸錯配導致最大的切割效率下降(85%~100%),他們還發現任何3個連續位置發生錯配會完全破壞這種切割,這些實驗初步地證實NgAgo-gDNA系統是高度保真的。
對于方舟子的質疑,韓春雨是這樣回答的
早前,韓春雨一經報道,就有細心的人在貼吧上找出了韓老師(郵箱已暴露了身份)。
而此次韓春雨老師的回復是其在“國際米蘭吧”上的回帖。網友“第十三米的陽光”引用方舟子的文章《河北科技大學韓春雨“諾貝爾獎級”實驗的重復性問題》中的內容在該貼吧內發帖。(http://tieba.baidu.com/p/4645810480?pid=93027569268&cid=0&from=prin#93027569268)↓↓↓
韓春雨老師用自己的“槐北路“的賬號進行了回復↓↓↓
對于方舟子和網友們提出的質疑,韓春雨在該回復里進行了詳解解答↓↓↓
有人能重復(FACS和Western?Blot),但那有可能是假陽性。
韓春雨的回復:細胞做好檢測,不要有寄生菌污染,不要有支原體污染(Ago系統對污染特別敏感——特別是單轉guide假陽性——我非常確定在沒有污染的情況下,單轉guid不會影響GFP表達,假陰性也大多因為細胞污染,假陽性和假陰性我都遇到過,國內買的細胞我就不吐槽了),轉染用的質粒質量要好(可用30ngGFP轉細胞,若是均一且效率高表明質量好,強弱不均一則表明質量差,越不均一表明質量越差),guide磷酸化完全(沒有磷酸化不能load和切割——謝謝印證我的Fig2結果,至于怎么檢測,自己跑個PAGE看看……)。
目前還未見有人反映重復出了圖4結果。
韓春雨的回復:Fig4,也是幾乎惟一算是有難度的,就是控制轉染時的細胞密度和用血清控制細胞生長,時間稍長,畢竟NgAgo未經過系統的密碼子優化——照著online?method上protocol?for?genome?editing?and?T7E1做(小經驗,PCR最好不要有引物二聚體,如果引物二聚體多請重設引物;PCR產物直接回收最好不跑膠回收,可能跟ago切24bp有關,設好對照!)銀染分辨率高,可以排除T7E1假陽性,能做出預期條帶后請用PCR產物去測序。歡迎大家廣泛使用此系統,并分享成功經驗和失敗教訓。附,addgen上的質粒,可以直接用作基因組編輯。再次強調,不加NgAgo,就能抑制GFP,是假陽性,是細胞出問題了(謝天謝地不但我自己而且審稿人也有這個對照)出現假陽性的細胞切基因組就沒戲了。對于Fig4,若是不習慣做銀染,也可以直接做KI:doner?用GFPcoden+polyA?signal,前后加幾個保護性的堿基——從GFP-N1擴出來連到T-vector上,再從此doner-Tvector上擴(防止GFP-N1污染的假陽性)出來純化,500-800ng共轉(for?each?well?of?24?well?plate)。
對于韓春雨的回復,方舟子進一步質疑
那么這種“高超的實驗技術“究竟是不是實驗細節的處理,不同網友也有自己的看法,有網友表示pcr已經有那么久的歷史,且機器已經半自動化,但目前也不是每個人次次都能成功。在實驗過程中,技術不難,難的是整個實驗過程都不能有半點差錯。關鍵一步都沒處理好,所以做不出來,但是恰恰是關鍵的一步?這也是他能做出來成果,別人做不出的原因。
韓春雨也強調了無污染細胞的重要性
而對于目前大家較為關注的重復性問題,目前網上雖然有一些表示沒有重復出來,一方面韓春雨老師經過幾年發表出來的結果,而目前大部分實驗室也只剛剛嘗試幾個月,另一方面一些網友認為目前重復不出來的原因也可能是在這個風口浪尖,為避免惹禍上身,重復出來的人也未必想站出來發聲。而且也有網友爆料來自印度的學者Dr. Debojyoti Chakraborty發言已重復出韓春雨NgAgo實驗。
Hi guys,
We have used this system and it works. We have followed the same protocol as mentioned in the paper and were able to confirm knockout both on FACS as well as western. We purified the oligos on gel after T4 PNK and saw the phenotype after 48 and 72 h.
cheers
debo
并且詳細分享了他們的protocol:
Here’s the protocol we followed:
We first phosphorylated the gDNA using the PNK kit from Ambion for 1 hr followed by heat inactivation at 95 degrees for 5 min. We then went on to transfect 100,000 cells in 12 well plates as follows:Mix 1:
Lipo reagent- 3ul
Optimem- 43ul
EGFP N1- 1 ug
NgAgo- 900 ng
gDNA- 500 ngMix 2:
Lipo 3000- 2ul
Optimem- 48ulMix 3:
Media- 250ul
Optimem- 150ulMix1 and Mix2 was incubated for 10min each and then both were mixed together and incubated at RT for 30min
This was now added to cells. To each well, 50 ul of Mix 3 was added on top. No further media was added to the cells.
After 12h, the mix was removed and fresh media was added.
科研成果的權威性是在質疑聲中建立起來的,而影響力越深遠、意義越重大的成果,受到的質疑就越多。最前沿領域的科研成果的鑒別通常異常困難,難以證明,也難以證偽。而檢驗一項新技術需要時間和客觀標準,實驗肯定有關鍵細節,韓春雨本人也不回避系統的不穩定性,也表示希望與同行進行交流,且目前在努力改進,即將推出2.0版和smart版,讓我們拭目以待吧。
來源:生物谷。